ワンちゃんとネコちゃんの腸活のお話
1. 飼い主様向けサマリー
当院は慢性炎症性腸症(CIE)、アトピー性皮膚炎の患者様が多く、それゆえ腸内細菌を整える治療(腸活?)のお話しをすることが多いのです。そろそろしつこいと思われているかなと思いますが、いったん腸活についてわかっている事をまとめて自分も勉強してみようと思いました。わんちゃん・ねこちゃんの腸内にすむ「腸内細菌」が、アトピー性皮膚炎やCIE、さらには行動や全身の健康にどのように関わっているかを、今わかっている内容でご説明いたします。また、腸内環境を整えるための食事の工夫やプロバイオティクスの使い方、そして「糞便微生物移植(FMT)」という新しい治療法についても、触れてみたいと思います。
2. はじめに:お腹のなかの小さな住人たち「腸内細菌」
私たちもそうですが、わんちゃん・ねこちゃんの腸の中には、目には見えないほど小さな生き物たちが数えきれないほどたくさん暮らしています。これらは「腸内細菌」とよばれ、その集まり全体を「腸内細菌叢(ちょうないさいきんそう)」または「腸内マイクロバイオータ」と呼びます。彼らはただ住んでいるだけでなく、食べ物の消化を助けたり、病気から体を守る免疫力を高めたり、さらには心の状態にまで影響を与える、とても大切なパートナーなのです[1, 2]。
健康な子の腸内では、さまざまな種類の細菌がバランスを取り合って共存しています。犬や猫の腸内で特に多く見られるのは、主に「バクテロイデーテス門」「ファーミキューテス門」「フソバクテリア門」といったグループの細菌です[3, 4]。このバランスが崩れること(ディスバイオーシスと呼ばれる状態)が、下痢や嘔吐といったお腹の不調だけでなく、アトピー性皮膚炎やその他の様々な病気の引き金になることが、近年の研究で明らかになってきました[1, 2, 5]。
興味深いことに、犬の腸内細菌叢は、機能的な観点からマウスよりも私たち人間のものと似ていることが報告されています[6, 7]。このため、犬は人間の病気を研究する上で貴重なモデル動物と見なされており、獣医療と人医療の両方で注目されています[8]。ただし、同じ家で暮らす飼い主と犬でも、皮膚の細菌叢はある程度共有されるものの、腸内細菌叢はそれぞれ独立している傾向があることも分かっています[9]。そんな腸内細菌たちは伴侶動物の健康にどう関わっているのでしょうか?
3. アトピー性皮膚炎と腸内細菌
アトピー性皮膚炎(CAD)は、強いかゆみを伴う皮膚の炎症が繰り返し起こる、わんちゃんによく見られるアレルギー性の皮膚病です。その発生率は3%から25%と報告されており、決して珍しい病気ではありません[10]。遺伝的な要因や、皮膚のバリア機能の低下、免疫の異常などが複雑に関係して発症すると考えられています[11, 12]。最近では、このアトピー性皮膚炎と腸内環境の間に深いつながりがあることが分かってきました。これを「腸-皮膚相関(Gut-Skin Axis)」と呼び、腸内細菌のバランスが皮膚の健康状態に影響を与えるという考え方です[13]。
3.1. アトピーっ子の腸内細菌の特徴
複数の研究で、アトピー性皮膚炎の犬と健康な犬とでは、腸内細菌の構成が異なることが報告されています。
スイスで行われたビーグル犬の研究では、アトピー性皮膚炎の犬は健康な犬に比べて、腸内細菌の種類が少なく(多様性が低い)、特定の細菌グループの割合が異なっていました。具体的には、健康な犬では「ラキノスピラ科(Lachnospiraceae)」や「ルミノコッカス科(Ruminococcaceae)」といった、一般的に腸の健康に良いとされる短鎖脂肪酸(SCFA)を作る細菌が多く見られたのに対し、アトピーの犬ではこれらの菌が少ない傾向にありました[14]。
フィンランドでの研究でも、アトピー症状のある犬と健康な犬とで腸内細菌の構成が異なることが示されています。この研究では、アトピー症状のある犬で「エシェリキア-シゲラ属(Escherichia-Shigella)」が増加し、健康な犬で多かった「プレボテラ_9属(Prevotella_9)」が減少していました。特に、エシェリキア-シゲラ属の増加は抗生物質の使用と関連があることも確認されており、アトピー症状と抗生物質の使用が関連している可能性も指摘されています[15, 16]。
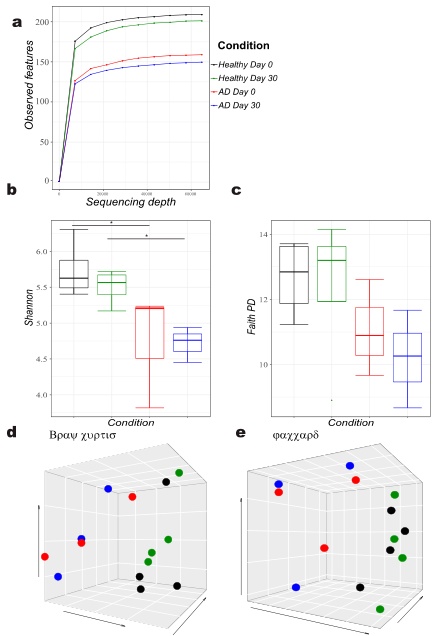
このグラフは、腸内細菌の多様性を示すシャノン指数を比較したものです。アトピー性皮膚炎(AD)の犬は、健康な犬(Control)に比べて、統計的に有意に多様性が低い(p=0.033)ことが示されています。腸内細菌の多様性が低いことは、腸内環境のバランスが乱れている(ディスバイオーシス)可能性を示唆します。
| 細菌グループ | Rostaher et al. (2022)[14] の報告 | Sinkko et al. (2023)[15] の報告 | 一般的な役割・特徴 |
|---|---|---|---|
| アトピー犬で減少する傾向の菌 | Lachnospiraceae科, Ruminococcaceae科, Faecalibacterium属, Fusobacterium属 | Prevotella_9属 | これらの多くは短鎖脂肪酸(特に酪酸)を産生し、腸のバリア機能や免疫の調整に重要な役割を果たします。 |
| アトピー犬で増加する傾向の菌 | Catenibacterium属, Megamonas属, Ruminococcus gnavus group | Escherichia-Shigella属 | 炎症を引き起こしたり、腸の粘液層を分解したりする可能性が指摘されている菌種が含まれます。 |
異なる研究で報告された、アトピー性皮膚炎の犬で増減する傾向にある腸内細菌をまとめました。研究によって対象となる犬種や環境が異なるため、結果に違いが見られますが、全体としてアトピーの犬では腸内環境のバランスが乱れていることが示唆されます。
3.2. 皮膚の細菌バランスも大切
アトピー性皮膚炎では、腸内だけでなく皮膚表面の細菌バランス(皮膚マイクロバイオーム)も乱れていることが知られています。健康な皮膚では多様な細菌が共存していますが、アトピー性皮膚炎の犬の皮膚では、細菌の種類が減少し、特定の菌、特に「スタフィロコッカス・シュードインターメディウス(Staphylococcus pseudintermedius)」が異常に増殖していることが多くの研究で報告されています[11, 17, 18]。この皮膚のディスバイオーシスが、かゆみや炎症をさらに悪化させる一因と考えられています。
ある研究では、犬のアトピー性皮膚炎に対して光線療法(エキシマライト)を行ったところ、かゆみや皮膚の赤みといった臨床症状が改善するとともに、皮膚の細菌バランスも改善し、Staphylococcus pseudintermediusの割合が減少したことが報告されました[19]。このことからも、皮膚の細菌バランスを整えることが、アトピー性皮膚炎の管理において重要であると言えます。
4. 慢性炎症性腸症(CIE)と腸内細菌
慢性炎症性腸症(Chronic Inflammatory Enteropathy: CIE)は、原因が特定できない慢性的な消化器の炎症を特徴とする病気です。症状としては、慢性的な下痢、嘔吐、食欲不振、体重減少などが見られます。この病気の発症には、腸内細菌叢の乱れ(ディスバイオーシス)が深く関わっていると考えられています[5, 21]。詳細は「https://www.rkomorebi-ah.com/archives/1730」をご覧ください。
4.1. CIEの子の腸内細菌の特徴
CIEの犬の腸内では、健康な犬と比べて明らかな細菌叢の乱れが観察されます。多くの研究で共通して報告されているのは、以下の点です。
- 細菌の多様性の低下:健康な腸に比べて、生息する細菌の種類が全体的に減少します[21, 22]。
- 有益な細菌の減少:腸の健康維持に重要な役割を果たす酪酸などの短鎖脂肪酸(SCFA)を産生する細菌、特にフソバクテリウム属(Fusobacterium)やフィーカリバクテリウム属(Faecalibacterium)などが著しく減少します[22, 23]。
- 胆汁酸代謝の異常:一次胆汁酸を二次胆汁酸に変換する重要な役割を持つ「クロストリジウム・ヒラノニス(Clostridium hiranonis)」という菌が減少します。二次胆汁酸は腸内環境を整え、病原菌の増殖を抑える働きがあるため、この菌の減少はディスバイオーシスをさらに悪化させる可能性があります[20, 23]。
- 潜在的な病原性菌の増加:「大腸菌(Escherichia coli)」や「クロストリジウム・パーフリンゲンス(Clostridium perfringens)」など、炎症を引き起こす可能性のある細菌が増加する傾向があります[21, 23]。
このような腸内細菌叢の乱れを客観的に評価する指標として、「ディスバイオーシス指数(Dysbiosis Index: DI)」というPCR検査が開発されています。この検査では、特定の7つの細菌グループと総細菌量を測定し、そのバランスから腸内環境の乱れの程度を数値化します。DIが高いほど、ディスバイオーシスの程度が重いことを示します[20, 24]。
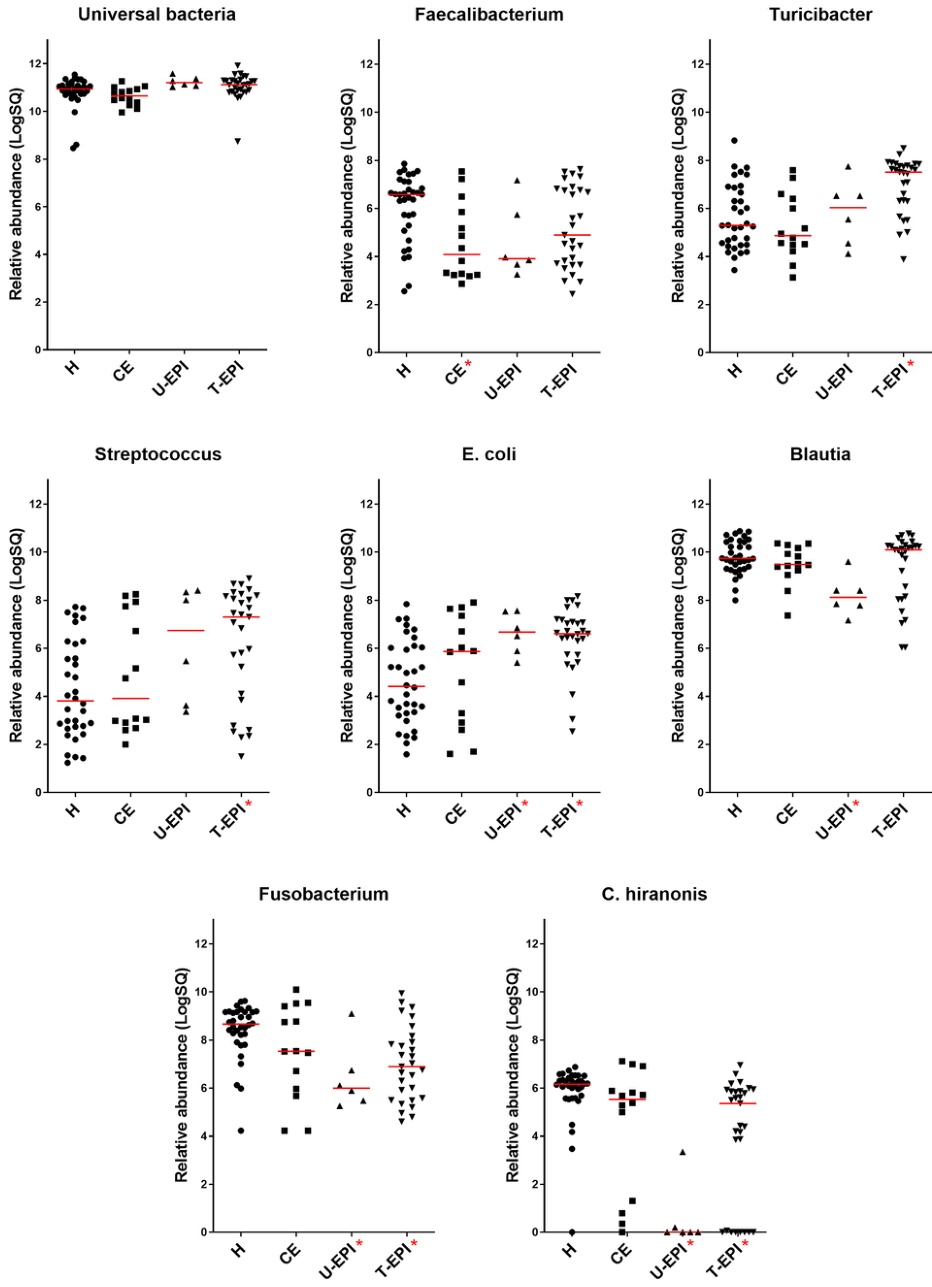
このグラフは、健康な犬(H)、慢性炎症性腸症(CIE)、膵外分泌不全(U-EPI, T-EPI)の犬の糞便中に含まれる特定の細菌の量(対数表示)を示しています。CIEの犬では、健康な犬に比べてフィーカリバクテリウム属(Faecalibacterium)が有意に減少していることがわかります(p=0.0303)。フィーカリバクテリウム属は、腸の健康に重要な酪酸を産生する代表的な善玉菌です。
4.2. 新しい治療法:糞便微生物移植(FMT)
糞便微生物移植(Fecal Microbiota Transplantation: FMT)は、健康なドナー(提供者)の便に含まれる腸内細菌叢を、病気のレシピエント(受給者)の腸内に移植することで、乱れた腸内環境を再構築する治療法です[25, 26]。人間では、特定の腸感染症に対して非常に高い効果が認められており、犬や猫のCIEに対しても、有望な治療選択肢として注目されています。
最近の犬の慢性炎症性腸症(CIE)に関する研究では、従来の食事療法に反応しなかった犬たちにFMTを行ったところ、17頭中10頭(59%)で臨床症状(下痢や嘔吐など)が改善し、その効果が長期間持続する可能性が示されました。この研究では、FMT後にディスバイオーシス指数(DI)や、乱れていた胆汁酸のバランスが改善したことも確認されています[20]。また、別の研究では、FMTによってCIEの犬で減少していたフソバクテリウム属(Fusobacterium)が有意に増加したことが報告されています[22]。
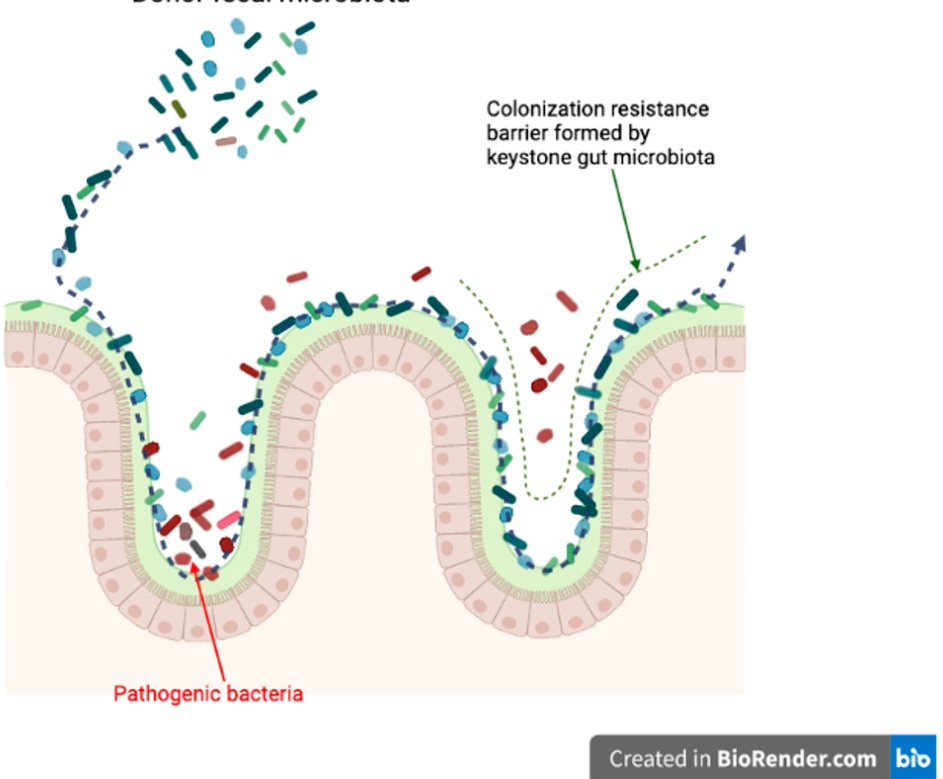
FMTの治療効果のメカニズムの一つに「ニッチェ排除」があります。これは、健康なドナー由来の多様な細菌がレシピエントの腸内に定着することで、病気の原因となっていた悪玉菌が住む場所(ニッチェ)や栄養を奪い、その結果として悪玉菌を腸内から追い出すという考え方です。
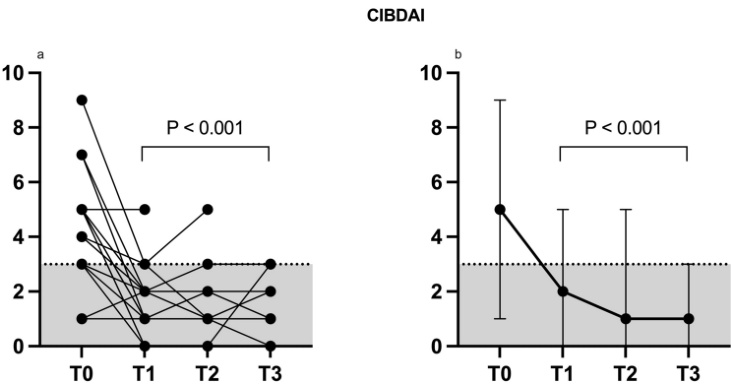
このグラフは、食事療法に反応しなかった慢性炎症性腸症の犬20頭における、FMT治療前(T0)と治療後30日(T1)、60日(T2)、90日(T3)の臨床症状の重症度スコア(CIBDAI)の変化を示しています。スコアが低いほど症状が軽いことを意味します。FMT後、CIBDAIスコアは有意に低下し、臨床症状が改善したことがわかります(p<0.0001)。
FMTは、経口カプセル、内視鏡、または浣腸によって行われます[27, 28]。まだ新しい治療法であり、ドナーの厳格な健康チェックが不可欠ですが、従来の治療法で改善が見られない場合の強力な選択肢となる可能性があります。これは当院でも行うことができる治療法です。
5. 全身の健康と腸内細菌
腸内細菌の役割は、お腹の中だけにとどまりません。腸は免疫、代謝、さらには脳の機能とも密接に連携しており、腸内細菌のバランスは全身の健康状態に大きな影響を与えます[1, 2]。
5.1. 「腸は第二の脳」:腸脳相関
腸と脳は、神経系、免疫系、内分泌系(ホルモン)を通じて、常にお互いに情報をやり取りしています。この双方向のつながりを「腸脳相関(Gut-Brain Axis)」と呼びます[13]。腸内細菌は、この腸脳相関において重要な役割を担っています。
例えば、腸内細菌は「セロトニン」や「GABA(ギャバ)」、「ドーパミン」といった、気分や行動を調節する神経伝達物質の生産に関わっています[13]。セロトニンは「幸せホルモン」とも呼ばれ、体内の90%以上が腸で作られています。腸内細菌のバランスが崩れると、これらの神経伝達物質の産生にも影響が及び、不安や攻撃性といった行動の問題につながる可能性が指摘されています。犬のてんかん(IE)に伴う不安行動に対して、特定のプロバイオティクス(ビフィドバクテリウム・ロンガム)の効果を検証する研究も進行中です[29]。
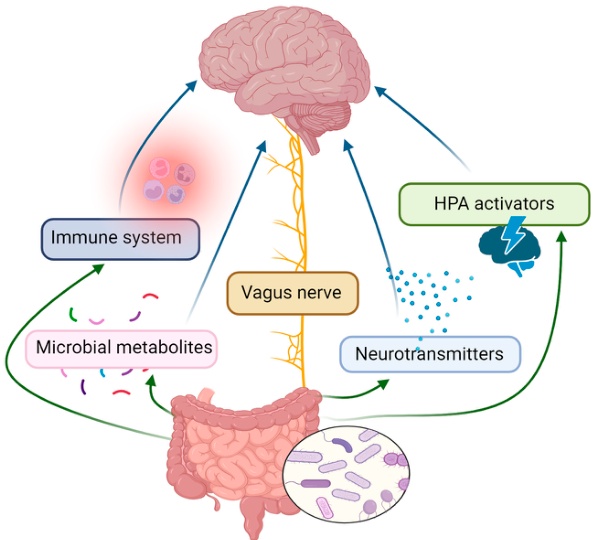
腸内細菌は、①迷走神経などの神経系、②サイトカインなどを介した免疫系、③ストレスホルモン(コルチゾールなど)を調節するHPA軸(内分泌系)、④短鎖脂肪酸(SCFA)などの代謝物を産生することを通じて、脳の機能や行動に影響を与えます。
5.2. 年齢や認知機能との関わり
人間と同じように、犬も年を重ねると腸内細菌のバランスが変化します。高齢の犬では、腸内細菌の多様性が低下する傾向が報告されています[30]。
さらに、腸内細菌叢と認知機能との関連も示唆されています。ある研究では、短期記憶テストの成績が良い犬は、成績が悪い犬に比べて、糞便中の「アクチノバクテリア門(Actinobacteria)」の割合が低いことが分かりました。また、高齢の犬では「フソバクテリア門(Fusobacteria)」が少ない傾向も見られました[30]。これらの発見は、将来的に腸内環境へのアプローチ、例えばFMTなどを通じて、高齢期の認知機能の維持や改善(犬の認知機能不全症候群、CCD)に貢献できる可能性を示しています[31]。
5.3. 慢性腎臓病(CKD)やその他の病気との関連
腸内細菌の乱れは、他の様々な病気とも関連しています。
- 慢性腎臓病(CKD):CKDは、特に高齢の猫で多く見られる病気です。腎臓の機能が低下すると、体内に「尿毒症毒素」と呼ばれる有害な物質が溜まります。この毒素の一部は、腸内細菌がタンパク質を分解する過程で作られます[32, 33]。CKDの犬や猫では、尿毒症毒素を産生する悪玉菌(プロテオバクテリア門など)が増え、善玉菌(ルミノコッカス属など)が減っていることが報告されています[33, 34]。特定のプロバイオティクス(乳酸菌混合物)をCKDの猫に8週間与えた研究では、腎機能の指標であるクレアチニン値が低下または維持され、生活の質(QOL)の改善も報告されました[32]。
- 糖尿病(DM):糖尿病の犬では、健康な犬と比べて腸内細菌叢が異なり、炭水化物の分解に関わる代謝経路が活発になっていることが報告されています。これは、腸内細菌が血糖値の管理に関与している可能性を示唆しています[35]。
- 胃拡張・胃捻転症候群(GDV):GDVを発症した犬は、健康な犬に比べて腸内細菌の多様性が高く、特定の免疫関連遺伝子の変異と関連していることが示唆されています。これは、免疫システムの遺伝的背景が腸内環境に影響し、GDVのリスクに関わっている可能性を示しています[36]。
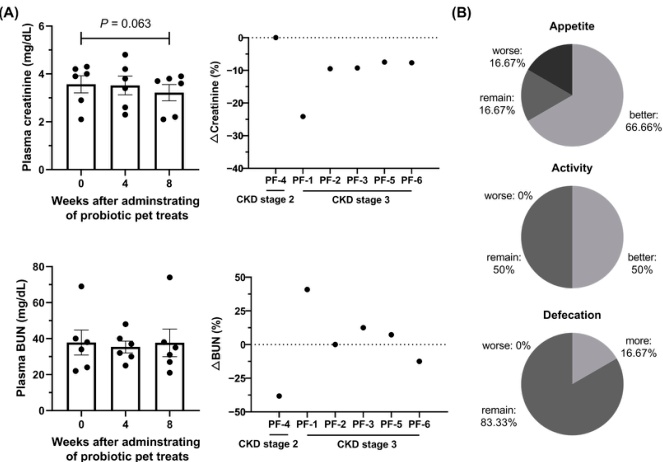
(A) 慢性腎臓病(CKD)の猫に腎臓保護機能を持つ乳酸菌混合物(Lm)を含むトリーツを8週間与えた後の、血中クレアチニン値の変化を示しています。全ての猫でクレアチニン値が減少または維持され、腎機能の悪化抑制に貢献した可能性が示唆されます。
(B) 飼い主様へのアンケート調査による生活の質(QOL)の変化です。「食欲」「活動性」「排便頻度」の項目で、多くの猫が改善または維持されたと評価されました。
6. 飼い主様への実用的なポイント
知っておきたい、お腹の健康のためのヒント
これまでの研究から、腸内細菌が伴侶動物の健康に深く関わっていることが分かりました。ここでは、文献で報告されている範囲で、飼い主様が日々の生活で実践できること、注意すべき点をご紹介します。
6.1. 食事管理について
- 食事は腸内環境の大きなカギ: 食事は腸内細菌叢の構成に最も大きな影響を与える要因の一つです[15, 37]。特に、タンパク質と炭水化物のバランスが重要です[38]。
- 食物繊維(プレバイオティクス)を意識する: ケストース(フラクトオリゴ糖の一種)のようなプレバイオティクスは、善玉菌であるビフィドバクテリウム属を増やし、腸の健康に良い酪酸の産生を促進することが犬で確認されています[39]。食物繊維を適切に加えることは、腸内環境を整えるのに役立つ可能性があります[40]。
- 急な食事変更は避ける: 腸内細菌は急な食事の変化に対応するのが苦手です。フードを切り替える際は、1週間以上かけて少しずつ新しいフードの割合を増やしていくようにしましょう。
6.2. プロバイオティクスについて
- プロバイオティクスとは: 腸内に良い影響を与える生きた微生物のことです。乳酸菌やビフィズス菌が有名です。
- 期待できる効果: 研究レベルでは、特定のプロバイオティクスが下痢や慢性炎症性腸症(CIE)、アトピー性皮膚炎、慢性腎臓病(CKD)などの症状を和らげる可能性が示されています。例えば、犬のアトピー性皮膚炎では、プロバイオティクスの投与で臨床症状スコアが有意に低下し、腸内細菌の多様性が増加したという報告があります[41]。猫においても、プロバイオティクスは免疫機能を高め、炎症を抑える効果が期待されています[42]。
- 選び方と使い方: プロバイオティクスの効果は、菌の種類や株によって異なります。また、動物の種類(犬か猫か)によっても効果的な菌は違う可能性があります。どの製品を選ぶべきか、どのくらいの期間与えるべきかについては、必ず獣医師に相談してください。
6.3. 糞便微生物移植(FMT)という選択肢
- FMTとは: 健康なドナーの便を病気のペットの腸に移植する、最先端の治療法です。腸内細菌叢をまるごと入れ替えることで、腸内環境を根本的に改善することを目指します[25, 26]。
- 対象となる病気: 現在、主に研究されているのは、従来の治療に反応しない難治性の慢性炎症性腸症(CIE)や、急性の下痢症などです[20, 27]。
- 注意点: FMTは専門的な医療行為であり、ドナーの便は、病原体や薬剤耐性菌がいないか厳しく検査される必要があります[26]。最近では、フリーズドライされた経口カプセルタイプのFMTも開発されておりますが、日本では手に入れ難い状況です[28, 43]。ご興味がある場合は、まずはかかりつけの獣医師に相談し、どのような方法が可能か相談してみるのが良いでしょう。
7. よくあるご質問(Q&A)
- Q1: うちの子の腸内環境が健康かどうか、どうすれば分かりますか?
- A1: 日々のうんちの状態(形、硬さ、色、におい)は、腸内環境のバロメーターになります。安定して良い状態のうんちが出ているなら、腸内環境も比較的安定していると考えられます。しかし、見た目だけでは分かりません。慢性的な下痢や軟便、嘔吐などの消化器症状が続く場合は、腸内細菌のバランスが乱れている(ディスバイオーシス)可能性があります。より正確に知るためには、動物病院で糞便検査を受けることが推奨されます。最近では、特定の細菌の量を測定して腸内環境の乱れを数値化する「ディスバイオーシス指数(DI)」のような検査もあります[20, 24]。
- Q2: プロバイオティクスはどのくらいの期間与えれば効果が出ますか?
- A2: 効果が現れるまでの期間は、症状や使用するプロバイオティクスの種類、個体差によって大きく異なります。例えば、猫の慢性腎臓病(CKD)に対する研究では、8週間の投与で腎機能マーカーや生活の質の改善が見られました[32]。犬のアトピー性皮膚炎に対する研究では、16週間の投与で臨床スコアの改善と腸内細菌叢の多様性増加が確認されています[41]。まずは獣医師の指示に従い、数週間から数ヶ月単位で継続して様子を見ることが一般的です。
- Q3: アトピー性皮膚炎は、腸の治療をすれば治りますか?
- A3: アトピー性皮膚炎は、腸内環境の乱れ(ディスバイオーシス)と関連があることが示唆されています[14, 15]。そのため、プロバイオティクスなどで腸内環境を整えることは、皮膚の症状を和らげる上で補助的な役割を果たす可能性があります[41]。しかし、アトピー性皮膚炎は皮膚のバリア機能の異常や免疫系の過剰反応など、多くの要因が絡み合った複雑な病気です[11, 12]。したがって、腸のケアだけで完治することは難しく、皮膚に対する適切な治療(外用薬、内服薬、スキンケアなど)と並行して行うことが、症状をコントロールする上で最も重要です。
- Q4: 糞便微生物移植(FMT)は安全な治療法ですか?
- A4: FMTは、適切に行われれば副作用が少なく、安全性の高い治療法とされています。報告されている副作用のほとんどは、一過性の軽度な消化器症状(下痢など)です[20, 25]。しかし、最も重要なのはドナーの選定です。健康に見えるドナーでも、便の中に病原体や薬剤耐性菌を持っている可能性があります。これらの病原体がレシピエントに感染するリスクを避けるため、ドナーには厳格な健康診断と糞便検査が不可欠です[26]。FMTは、こうしたリスク管理が徹底された専門施設の製品を使用し、獣医師の監督のもとで行われるべき治療です。
8. 参考文献
このドキュメントは、以下の査読付き科学論文を主な情報源として作成されました。各記述の末尾にある上付き数字は、対応する参考文献番号を示しています。完全な書誌情報とアクセス可能なリンクは以下の通りです。
- Suchodolski, J. S. (2021). Analysis of the gut microbiome in dogs and cats. Veterinary Clinical Pathology, 51(S1), 6-17. https://doi.org/10.1111/vcp.13031
- Huang, Z., Pan, Z., Yang, R., Bi, Y., & Xiong, X. (2020). The canine gastrointestinal microbiota: early studies and research frontiers. Gut Microbes, 11(4), 635–654. https://doi.org/10.1080/19490976.2019.1704142
- Kubinyi, E., Bel Rhali, S., Sándor, S., Szabó, A., & Felföldi, T. (2020). Gut Microbiome Composition is Associated with Age and Memory Performance in Pet Dogs. Animals, 10(9), 1488. https://doi.org/10.3390/ani10091488
- Swanson, K. C., et al. (2011). The canine gut microbiome is more similar to the human microbiome than is the murine. The ISME Journal, 5, 1039–1041. https://doi.org/10.1038/ismej.2010.162
- Al-Ghazal, A., et al. (2021). Gut Microbiota Composition in Relation to Intestinal Inflammation and Disease in Domestic Animals. Frontiers in Genetics, 12, 649599. https://doi.org/10.3389/fgene.2021.649599
- Coelho, L. P., et al. (2018). Similarity of the dog and human gut microbiomes in gene content and response to diet. Microbiome, 6(1), 72. https://doi.org/10.1186/s40168-018-0450-3
- Pilla, R., & Suchodolski, J. S. (2020). The Role of the Canine Gut Microbiome and Metabolome in Health and Gastrointestinal Disease. Frontiers in Veterinary Science, 6, 498. https://doi.org/10.3389/fvets.2019.00498
- Kleber, K. T., et al. (2022). Using the canine microbiome to bridge translation of cancer immunotherapy from pre-clinical murine models to human clinical trials. Frontiers in Immunology, 13, 983344. https://doi.org/10.3389/fimmu.2022.983344
- Lehtimäki, J., et al. (2020). Simultaneous allergic traits in dogs and their owners are associated with living environment, lifestyle and microbial exposures. Scientific Reports, 10(1), 21954. https://doi.org/10.1038/s41598-020-79055-x
- Drechsler, Y., Dong, C., Clark, D. E., & Kaur, G. (2024). Canine Atopic Dermatitis: Prevalence, Impact, and Management Strategies. Veterinary Medicine: Research and Reports, 15, 19–26. https://doi.org/10.2147/VMRR.S412570
- Santoro, D., et al. (2024). Update on the skin barrier, cutaneous microbiome and host defence peptides in canine atopic dermatitis. Veterinary Dermatology, 35(1), 5–14. https://doi.org/10.1111/vde.13215
- Olivry, T., et al. (2021). Characterization of the pro-inflammatory and pruritogenic transcriptomes in an anti-IgE-induced canine atopic dermatitis model. Veterinary Sciences, 11, 109. https://doi.org/10.3390/vetsci11030109
- Kiełbik, P., & Witkowska-Piłaszewicz, O. (2024). The Relationship between Canine Behavioral Disorders and Gut Microbiome and Future Therapeutic Perspectives. Animals, 14(14), 2048. https://doi.org/10.3390/ani14142048
- Rostaher, A., et al. (2022). Comparison of the gut microbiome between atopic and healthy dogs—preliminary data. Animals, 12(18), 2377. https://doi.org/10.3390/ani12182377
- Sinkko, H., et al. (2023). Distinct healthy and atopic canine gut microbiota is influenced by diet and antibiotics. Royal Society Open Science, 10(4), 221104. https://doi.org/10.1098/rsos.221104
- Sinkko, H., et al. (2023). Distinct healthy and atopic canine gut microbiota is influenced by diet and antibiotics. bioRxiv. https://doi.org/10.1101/2022.08.23.504944
- Timm, A., et al. (2024). Bacterial microbiome on healthy and inflammatory altered canine skin. Frontiers in Microbiology, 15, 1528747. https://doi.org/10.3389/fmicb.2024.1528747
- Proverbio, D., et al. (2020). The bacterial communities of the dermis and subcutis in healthy dogs are not sterile. Communications Biology, 3, 50. https://doi.org/10.1038/s42003-020-0775-z
- Park, J.-Y., Kim, S.-M., & Kim, J.-H. (2021). Efficacy of Phototherapy With 308-nm Excimer Light for Skin Microbiome Dysbiosis and Skin Barrier Dysfunction in Canine Atopic Dermatitis. Frontiers in Veterinary Science, 8, 762961. https://doi.org/10.3389/fvets.2021.762961
- Vecchiato, C. G., et al. (2024). Effect of faecal microbial transplantation on clinical outcome, faecal microbiota and metabolome in dogs with chronic enteropathy refractory to diet. Scientific Reports, 14, 96906. https://doi.org/10.1038/s41598-024-59606-w
- Chae, M., et al. (2021). Fecal microbiota transplantation for canine inflammatory bowel disease: A case report. Bioscience of Microbiota, Food and Health, 40(3), 98–103. https://doi.org/10.12938/bmfh.2020-058
- Niina, A., et al. (2019). Fecal microbiota transplantation as a new therapy for canine inflammatory bowel disease. Journal of Veterinary Medical Science, 81(9), 1330-1335. https://doi.org/10.1292/jvms.19-0071
- Blake, A. B., et al. (2019). Altered microbiota, fecal lactate, and fecal bile acids in dogs with gastrointestinal disease. PLoS ONE, 14(10), e0224454. https://doi.org/10.1371/journal.pone.0224454
- AlShawaqfeh, M. K., et al. (2017). A dysbiosis index to assess microbial changes in fecal samples of dogs with chronic inflammatory enteropathy. FEMS Microbiology Ecology, 93(11), fix136. https://doi.org/10.1093/femsec/fix136
- Tuniyazi, M., Hu, X., Fu, Y., & Zhang, N. (2022). Canine Fecal Microbiota Transplantation: Current Application and Possible Mechanisms. Veterinary Sciences, 9(8), 396. https://doi.org/10.3390/vetsci9080396
- Pereira, G. Q., et al. (2022). Fecal Microbiota Transplantation in Companion Animals: A Review of the Literature. Journal of Veterinary Internal Medicine, 36(4), 1235-1245. https://doi.org/10.1111/jvim.16458
- Chae, M., et al. (2021). A case report of successful treatment of chronic enteropathy in a dog with fecal microbiota transplantation. Animals, 11(5), 1433. https://doi.org/10.3390/ani11051433
- Lee, S., et al. (2023). Effect of the Administration of a Lyophilised Faecal Capsules on the Intestinal Microbiome of Dogs: A Pilot Study. Genes, 14(8), 1676. https://doi.org/10.3390/genes14081676
- McGrath, S., et al. (2023). A randomized controlled trial of a psychobiotic in dogs with idiopathic epilepsy. BMC Veterinary Research, 19(1), 49. https://doi.org/10.1186/s12917-023-03609-0
- Kubinyi, E., et al. (2020). Gut Microbiome Composition is Associated with Age and Memory Performance in Pet Dogs. Animals, 10(9), 1488. https://doi.org/10.3390/ani10091488
- Plassais, J., et al. (2022). Fecal Microbiome Transplantation as a Putative Therapy for Canine Cognitive Dysfunction. Frontiers in Veterinary Science, 9, 841332. https://doi.org/10.3389/fvets.2022.841332
- Tsai, C.-W., et al. (2024). Investigating the Efficacy of Kidney-Protective Lactobacillus Mixture-Containing Pet Treats in Feline Chronic Kidney Disease and Its Possible Mechanism. Animals, 14(4), 630. https://doi.org/10.3390/ani14040630
- Summers, S. C., et al. (2020). Gut–Kidney Axis Investigations in Animal Models of Chronic Kidney Disease. Toxins, 14(9), 626. https://doi.org/10.3390/toxins14090626
- Kim, K.-R., Kim, S.-M., & Kim, J.-H. (2023). A pilot study of alterations of the gut microbiome in canine chronic kidney disease. Frontiers in Veterinary Science, 10, 1241215. https://doi.org/10.3389/fvets.2023.1241215
- Koo, T. Y., et al. (2023). Gut microbiome differences between healthy and diabetic dogs in Hong Kong. Animals, 13(15), 2479. https://doi.org/10.3390/ani13152479
- Zitomer, S. T., et al. (2018). Gut microbiome-based prediction of gastric dilatation-volvulus in a high-risk dog breed. PLoS ONE, 13(5), e0197686. https://doi.org/10.1371/journal.pone.0197686
- Scarsella, E., et al. (2022). Network-based gut microbiome analysis in dogs. Italian Journal of Animal Science, 21(1), 1465-1475. https://doi.org/10.1080/1828051X.2022.2124932
- Li, Q., et al. (2017). Effects of the dietary protein and carbohydrate ratio on gut microbiomes in dogs of different body conditions. mBio, 8(1), e01703-16. https://doi.org/10.1128/mBio.01703-16
- Niina, A., et al. (2019). Prebiotic effects of kestose on the intestinal microbiota and fecal short-chain fatty acid concentrations in healthy adult beagle dogs. Journal of Veterinary Medical Science, 81(9), 1330-1335. https://doi.org/10.1292/jvms.19-0071
- Herstad, K. M. V., et al. (2010). A diet supplemented with brewers’ yeast cell wall mannan-oligosaccharides and beta-glucans affects the duodenal and jejunal mucosal morphology and caecal microbiota of dogs. Journal of Animal Physiology and Animal Nutrition, 94(5), 591-599. https://doi.org/10.1111/j.1439-0396.2009.00953.x
- Kim, H. S., et al. (2022). Therapeutic effects of probiotics on the clinical signs and gut microbiota in dogs with atopic dermatitis. BMC Veterinary Research, 18(1), 3924. https://doi.org/10.1186/s12917-022-03294-z
- Covino, S., et al. (2023). Effects of Probiotic Supplementation on the Health and Well-Being of Domestic Cats: A Comprehensive Review. Veterinary Sciences, 12(11), 703. https://doi.org/10.3390/vetsci12110703
- Kim, H., et al. (2023). Retrospective case series on the use of commercially available oral fecal microbiota transplantation in dogs and cats with chronic enteropathies. Journal of Veterinary Clinics, 41(3), 150-155. https://doi.org/10.17555/jvc.2024.02.41.3.150


